ENERGIE DE LA VAPEUR D'EAU
DIAGRAMME T S
Sur
le diagramme température T / S les surfaces
représentent des quantités
de chaleur. En ordonnée T, la température, commence à -273,15°C soit le zéro absolu (tous les atomes sont immobiles).
En abscisse S = entropie : grandeur utilisée en thermodynamique qu'il n'est pas nécessaire de connaître pour comprendre le diagramme (pour les curieux S=Somme de dQ/T).
Pour un fluide à la pression P1, pour passer d'une température TA à TB il faut apporter une quantité de chaleur égale à la surface hachuée en orange. Plus la surface est grande, plus TB est élevée.
Pour l'eau , on a mesuré les quantités de chaleur nécessaires pour passer d'un état (pression, température) à un autre : après beaucoup de mesures on obtient le diagramme TS de l'eau ci dessous en reliant les points de même pression (courbes vertes).
DIAGRAMME T S DE l'EAU
 Suivons la courbe verte 1b (1 bar = pression atmosphérique) :
Suivons la courbe verte 1b (1 bar = pression atmosphérique) :Si on chauffe de l'eau à 1b à 0°C, sa température va monter de 0 à 100°C. La surface sous cette courbe (hachures jaunes) indique la quantité de chaleur utilisée (valeur numérique = 426 kilo joules par kg d'eau : kj/kg).
Si on continue à chauffer, la température reste à 100°C et l'eau va s'évaporer. La surface sous la courbe (hachures rouges) indique la quantité de chaleur utilisée (valeur numérique = 2271 kj/kg). Si on utilise les 3/4 de cette chaleur, il y aura 75 % de vapeur et 25 % d'eau : on dit que le titre de vapeur est de 0.75. (le point sur la courbe sera à l'intérieur de la courbe bleue en cloche)
Si on continue à chauffer, la température de la vapeur va monter. La surface sous la courbe (hachures oranges) indique la quantité de chaleur utilisée (plus la surface augmente plus la température augmente).
On voit d'autre courbes vertes pour les pressions 10b, 20b et 100b. Si on relie les points de début et fin d'ébullition pour les différentes pressions, on obtient la courbe bleue en forme de cloche (son sommet correspond au point critique 220 b 374°C).
A la pression atmosphérique, il faut 5.3 fois plus de chaleur pour évaporer 1 kg d'eau que pour la faire chauffer de 0 à 100°C.
A la pression de 20 b ce rapport passe à 2.1 (920 kj/kg pour chauffer l'eau et 1941 kj/kg pour évaporer).
Pour de l'eau à la pression critique toute la chaleur est utilisée pour chauffer l'eau (il n'y a plus de vaporisation).
Plus la pression est élevée plus il faut de chaleur pour porter l'eau à ébullition.
Pour les basses pressions, l'énergie de transformation eau <--> vapeur est importante : On voit l'importance, dans les machines, d'utiliser la vapeur jusqu'à une pression la plus faible possible pour récupérer le plus d'énergie possible. (Exemple machine du Titanic : la turbine qui ne fonctionne que de 0,6 à 0,07 bars fournit une puissance égale à 60% de celle des machines à pistons triple expansion qui utilisent pourtant la vapeur de 15 à 0,6 bars. Voir page machines).
Plus la pression monte plus les courbes de pression sont proches. Ainsi la surface entre les courbes 1b et 10b est plus importante qu'entre les courbes 10b et 20b.
Exemple :
pour chauffer depuis 0°C puis évaporer à une pression de 42 mb (30°C) 1 kg d'eau il faut dépenser 2570 kj.
si on passe à 1 b (100°C) il faut ajouter 127 kj
si on passe à 10 b (180°C) il faut ajouter 127 kj
si on passe à 20 b (213°C) il faut ajouter 30 kj
(la quantité de chaleur à ajouter est faible quand on monte en pression : le point d'intersection courbe verte / courbe bleue remonte, ce qui augmente la surface, mais se déplace également vers la gauche, ce qui la diminue)
Télécharger un fichier pdf du diagramme T S : Diagramme-Ts-eau.pdf
Page pour convertir les unités d'énergie (kwh, kcal, kj, kg charbon / ch h) : convertisseur
Danger de la vapeur
On voit que la vapeur n'est pas dangereuse seulement à cause de sa température élevée, mais par la grande quantité d'énergie qu'elle contient :exemple : comparaison de la chaleur de refroidissement d'un litre de vapeur et d'un litre d'air passant de 100 à 37°C à 1 b (par exemple sur la peau).
- 1 litre de vapeur fournit 1.15 kj (275 calories : de quoi chauffer 10cl d'eau de 27.5°C)
- 1 litre d'air sec fournit 0.06 kj (14 calories : de quoi chauffer 10cl d'eau de 1.4°C).
En effet la vapeur contient l'énergie consommée pour chauffer et évaporer l'eau d'où elle vient.
Application météo
 Le
changement d'état eau / vapeur joue un rôle
important dans
les
phénomènes météo et dans le
transfert
d'énergie solaire : Le
changement d'état eau / vapeur joue un rôle
important dans
les
phénomènes météo et dans le
transfert
d'énergie solaire :Sur l'équateur le soleil chauffe l'air et l'eau : il se forme de l'air humide qui absorbe de l'énergie, chauffe et s'éléve en créant une dépression. Cette énergie est redonnée quand l'air redescend dans les anticyclones. En montant l'air humide se détend et donc sa température baisse, jusqu'à condenser en pluie. L'énergie de condensation permet à l'air d'altitude d'être moins froid que si l'air avait été sec au départ. Cette chaleur nous revient quand l'air redescend (l'air se comprime et donc sa température augmente). exemple : énergie contenue dans un kg d'air, par rapport à de l'air sec à 0°C : air sec à 30°C contient 30 kj alors qu'avec une humidité de 100% il contient 100 kj. (les 70 kj de différence correspondent à la chaleur contenue dans les 27 g de vapeur / kg d'air). |
Influence de l'humidité sur la stabilité d'une masse d'air :
Considérons une masse d'air moyenne. Sa pression diminue avec l'altitude et sa température aussi (-6.5°C par 1000 m).
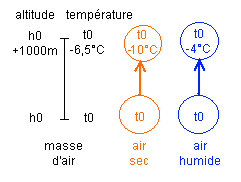 Si
on fait monter de l'air sec en altitude (relief avec du vent ou
dépression), sa pression diminue et donc il
se refroidit par détente (-10°C par 1000 m). Il se
refroidira plus vite
que l'air ambiant et aura tendance à redescendre reprendre
sa place
initiale : l'air est stable.
Si
on fait monter de l'air sec en altitude (relief avec du vent ou
dépression), sa pression diminue et donc il
se refroidit par détente (-10°C par 1000 m). Il se
refroidira plus vite
que l'air ambiant et aura tendance à redescendre reprendre
sa place
initiale : l'air est stable.Si on fait monter de l'air humide en altitude, il se refroidit également par détente. Mais si pour une pression donnée la température est trop basse pour que la vapeur reste stable, une partie de la vapeur va condenser en redonnant de la chaleur à l'air. Ainsi l'air humide peut se refroidir moins vite que l'air ambiant (par exemple -4°C par 1000m). Il sera plus chaud qu'elle et aura tendance à monter encore plus : l'air est instable.
Ces phénomènes sont très importants en météorologie. Ils participent à la formation des orages, ouragans...
Applications dans la vie courante
Intérêt de mettre un couvercle sur une casserole :Quand on chauffe de l'eau dans une casserole, avant d'atteindre les 100°C, il y a équilibre entre l'eau et la tension (pression partielle voir page précédente) de vapeur présente dans l'air. Quand la température augmente, de l'eau va s'évaporer pour augmenter la tension de vapeur dans l'air au dessus de la casserole pour rétablir l'équilibre. La chaleur utilisée pour évaporer cette eau ne servira pas à chauffer la casserole. On voit sur le diagramme que cette chaleur de vaporisation est importante.
Même phénomène quand on soulève la croûte d'un gratin pour qu'il refroidisse.
Intérêt de souffler sur une cuillère de soupe :
L'eau de la soupe s'évapore pour augmenter la tension de vapeur présente dans l'air. La chaleur utilisée pour évaporer cette eau servira à baisser la température de la cuillère.
La vapeur d'eau au dessus de la cuillère ne diffuse pas instantanément et il se forme une bulle d'air plus humide. Le fait de souffler (en plus d'améliorer la convection) permet de renouveler l'air et donc de maintenir une tension de vapeur faible, ce qui accélère l'évaporation et le refroidissement.
Valeurs numériques : pour refroidir une cuillère de 15 ml (15g) d'eau de 90°C à 30°C il faut 60*15 =900 cal (3.7 kj) . Pour évaporer de l'eau à 60°C il faut 2.37 kj/g. Il suffit d'évaporer environ 3.7 / 2.37=1.5g d'eau pour refroidir la cuillère.
Transpiration :
L'eau qui s'évapore sur la peau à 37°C prend 2423 kj/kg (579 kcal/litre) : 1 litre d'eau qui s'évapore à 37°C permet de faire baisser la température de 60 litres d'eau de 9.6°C (=579 / 60).
Il y a peu d'animaux qui utilisent la transpiration extérieure pour réguler leur température (homme, cheval, ...). Cela permet de maintenir des efforts dans la durée (marathon, ...). Il paraît que certaines tribus poursuivent le gibier assez longtemps pour provoquer un "coup de chaud" chez la proie qui est de ce fait affaiblie (voir paralysée). En effet son système de refroidissement est moins performant que celui de l'homme pour un effort de longue durée.
Temps "lourd" :
Le corps humain est sensible à l'énergie (température et humidité) de l'air. On dit qu'il fait "lourd" avant un orage. Si l'air est trop humide, la transpiration ne permet plus de nous refroidir, d'où le malaise. Il existe l'indice humidex pour mesurer cet inconfort.
En savoir plus sur Humidex
Chaudière à condensation :
Après la combustion du gaz ou du fuel il y a de la vapeur d'eau dans les fumées. Si l'eau de retour des radiateurs est suffisamment froide, il est possible de faire condenser cette vapeur et de récupérer la chaleur qu'elle contient.
"Fumer comme un pompier" :
L'origine de l'expression remonte en fait à une époque où les vêtements ignifuges n'existaient pas et où nos valeureux soldats du feu, vêtus de simple coton ou de laine, se faisaient copieusement arroser d'eau avant d'entrer dans un endroit enflammé. Une fois dans l'enfer, cette eau portée à haute température se transformait en vapeur (en refroidissant le pompier). Et lorsqu'ils ressortaient, une grande quantité de fumée du lieu et de vapeur d'eau s'échappait de leur tenue.